神经电极的发展历程
1 引言
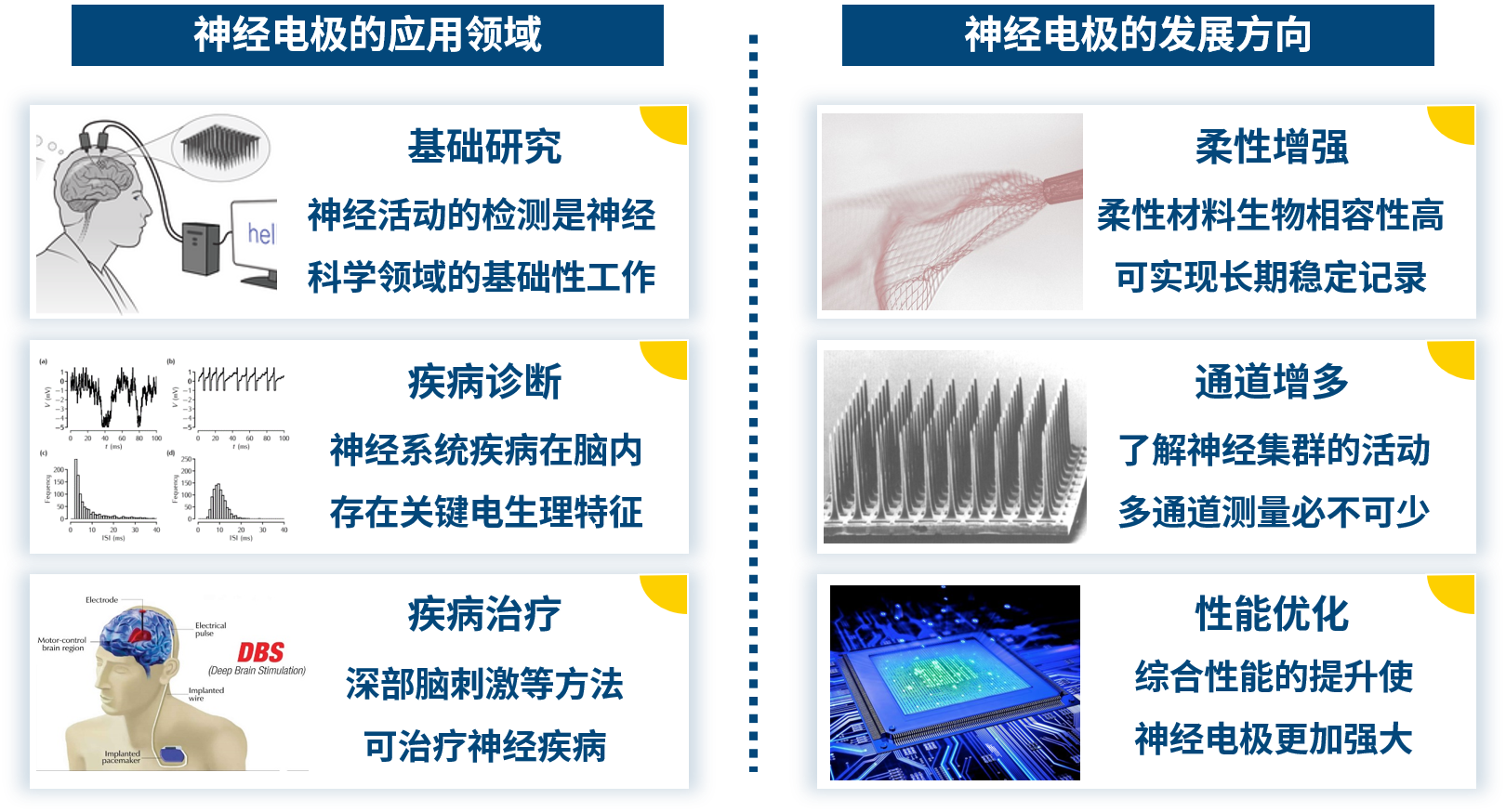
1.1 神经电极概论
脑是所有脊椎动物都具有的神经系统中心,是机体中最复杂的器官。由于脑的机能主要依靠神经元之间电信号的传导,因此神经信号的检测对于脑运作机制的研究以及神经系统疾病的诊断和治疗十分重要。
神经电极是用来检测神经电信号的电极。自 20 世纪初期以来,神经电极一直朝着柔性增强、通道数增多以及综合性能优化三个方向发展。首先,采用柔性材料制备的神经电极与脑组织力学性能匹配更好,对组织产生的干扰和破坏更轻微,可实现长期稳定的记录;另外,神经电极的通道数也在增多,可以检测到更广范围、更多神经元的信号,这对于了解神经元集群的活动至关重要。最后,神经电极在尺寸、信号传输带宽等方面的综合性能的优化使其成为愈发强大的神经科学研究工具。目前,已能够通过神经电极初步解读和影响大脑功能,在神经系统疾病治疗[1,2]和神经义肢[3]等领域取得了可喜的成果,但同时神经电极仍然面临着许多亟待解决的问题。本文将系统性介绍神经电极的发展历程和最新研究成果。
1.2 神经电极的分类
神经电极按照是否植入到大脑内部,分为侵入式和非侵入式两种[4]。非侵入式电极主要包括头皮电极(Electroencephalogram,EEG),而侵入式电极主要包括放置于硬脑膜之下,在大脑皮层表面的皮层电极(Electrocorticogram,ECoG)和植入大脑内部的植入式电极。由于 EEG 是在头皮记录信号,而信号会被低电导率的颅骨显著衰减,因此 EEG 测得的信号幅值较低,信息量较少,其时空分辨率远低于侵入式电极。
相比于 EEG ,侵入式电极由于距离神经元更近,因此能够以更高的空间分辨率记录到高保真的动作电位(Action Potential,AP)信号,因此在脑科学研究中,多采用侵入式电极进行电生理记录,但侵入式电极的材料与脑组织的力学不匹配将不可避免地导致暂时或永久性的植入损伤和免疫反应[5]。因此为了提高电极的生物相容性,必须缩减电极尺寸并通过改变电极材料使得电极的柔性与脑组织相近,即“柔性微电极”。第二章将介绍非柔性和柔性微电极的发展历史。
1.3 电生理记录系统的构成
通过神经电极记录到的信号需要进行传输和存储,才能进行进一步处理和分析,因此一套完整的电生理记录系统应由如下组件连接而成:
- 具有记录位点的电极(又称作“探针”),负责采集信号
- 前置信号处理芯片,负责信号的模数转换和增益
- 数据采集系统(一般为计算机软件),负责将数据流存储在存储单元中
- 数据处理系统(搭载于高性能计算机),负责进行信号处理

其中电极与脑组织相接的部分称为“神经界面”(广义上神经界面也指代电极和前置芯片的组合)。由于本文的重点在于电极部分,因此不讨论数据采集和数据处理,而将重点放在神经界面部分。
2 神经电极的发展历程
2.1 非柔性微电极的发展历史
2.1.1 金属微丝电极
在电生理研究早期,受制备工艺的限制,电极尺寸比一般神经纤维尺寸(1-25 μm)大一到两个数量级。因此,初期电生理研究大多在枪乌贼等具有大直径(1 mm左右)轴突的生物上进行,如 1939 年霍奇金和赫胥黎对静息电位和动作电位的记录[6]。1949 年,美籍华人凌宁制作出了尖端直径小于 1 μm 的玻璃毛细管微电极;1957 年,Hubel 使用电化学刻蚀钨丝并包覆绝缘层的方法,制备出尖端直径 0.5 μm 左右的钨微丝电极(图 2.1a)[7],且其机械强度相比于玻璃毛细管电极有很大提升,可以穿透硬脑膜,使得脑内电记录成为可能[8]。
为了获得更丰富的神经活动信息,只使用具有单一记录位点的单根电极是不够的,必须开发具有更多记录位点的电极。电极位点增多不仅意味着可以探测到更广范围内的神经元信号,还能结合位点的空间位置和所测得信号的幅值等特征对神经元进行更精确的定位[9]。我们将具有多个记录位点的电极称为多通道电极。
多通道电极的发展是从金属微丝电极开始的。1983 年,McNaughton 等人制备出金属微丝双电极(图 2.1b)[10]。他们首先将直径 25 μm 的铂铱合金丝用厚度为 6 μm 聚四氟乙烯绝缘层包覆,后将两根丝按照每厘米 20 圈紧密绞合,并在横断面上镀铂,使其阻抗从 1 MΩ 降至 200-500 kΩ 左右。该电极能够在两个位点同时记录到同一神经元的信号,并且总共分离出了 4 个神经元。1993 年,同研究团队采用类似方法,进一步制备出 金属微丝四电极(tetrode) 并进行了海马体神经元集群活动的记录与分析[11],展示出多通道电极进行复杂神经信号记录的潜力。Tetrode 电极至今仍在被广泛使用。

(a)Hubel制备的钨丝微电极[7](b)金属微丝双电极的切面[10]
金属微丝电极的制备流程虽然简单,但在通道数增多时,除了电极尺寸增大,电极与记录系统之间的引线数量也会明显增多,而集成电路工艺为多通道电极与记录系统的连接提供了一条高效的解决方法。互补式金属氧化物半导体(Complementary Metal-Oxide-Semiconductor,CMOS)器件是一种常用的半导体器件,常见于图像传感装置、微处理器等集成电路组件。CMOS 器件不仅实现了工业化生产,其高密度、阵列化的特点也与多通道神经电极具有潜在的匹配性。2020 年,Melosh 等人提出将微丝电极阵列与 CMOS 器件结合起来的连接范式[12]。该范式的核心内容为具有等间距的微丝电极束与 CMOS 器件表面的贴合(图 2.2a)。为了实现微丝的等间距排列,他们首先将包覆了陶瓷或聚合物绝缘层的合金丝通过化学气相沉积的方法沉积厚度 1-100 μm 的聚氯代对二甲苯(Parylene-C)牺牲层,将沉积后的微丝捆扎固定在一起,这样牺牲层的厚度将决定微丝间的距离,并且可以保证距离相近。用等离子体刻蚀掉微丝两端的牺牲层,使得两侧的微丝尖端暴露,其中一侧暴露的微丝较长,作为探针植入脑组织(图 2.2b);另一侧较短,与 CMOS 器件贴合。他们采用含数十万至数百万像素点的照相机感光元件与微丝束进行了贴合,连通率达到了 90% 以上。为了检验其在体电生理记录性能,他们使用 200 左右通道数、间距 100μm、长度 1-2 mm 的微丝电极束植入小鼠皮层,成功分离出 100-200 个神经元信号。

(a)连接示意图(b)Argo系统微丝束尖端(c)Argo系统电极照片
2021年,Kunal Sahasrabuddhe 等人采用专为电生理记录设计的 CMOS 器件,配合高性能前置芯片,对记录系统进行了全面升级,并命名为“Argo”[13]。Argo 系统的传输带宽大幅度提高至 26 Gbps,支持对 65536 个通道的同时记录,且采样率高达 32 kHz。他们采用 1300 根微线检测到小鼠皮层 792 个神经元的信号,并在 3 万多个通道检测到局部场电位(LFP)信号。Argo 是当前在小鼠和山羊上最大通道数的微丝电极。
2.1.2 硅基电极
随着半导体技术的发展,人们可以对材料进行微米甚至纳米级的形貌控制。上述的 CMOS 器件就是范例之一,但直接用单晶硅制备神经电极要比 CMOS 器件应用到神经电极早得多。1970 年,第一个应用精密半导体制造工艺的多电极阵列被制造出来,称为密歇根型电极阵列(Michigan electrodes)[14,15]。这类电极阵列运用微纳加工技术,将硅片蚀刻成一排针尖,并镀上一层导电层,最后将除电极尖端的部分用绝缘胶涂覆(图 2.3a)。后来,这类电极的位点从分立的针尖转变为分布在电极柄的侧面(见图 2.5a)。1997 年,另一种硅基多电极阵列问世,称为犹他电极阵(Utah array)[16]。这类电极通过将硅片刻蚀成微针制备而成(图 2.3b)。犹他电极阵虽然只有微针的尖端是暴露的,尺寸和通道数也比较固定(64 通道或 100 通道),但由于积极推进制造工艺标准化,现已被批准临床使用。

(a)2通道的密歇根型电极阵列[14](b)100通道的犹他电极阵[16]
随着微纳加工技术的发展,硅基电极的通道数不断增加,尺寸不断降低。2016 年,Gustavo Rios 等人成功制备出具有 1024 个通道的三维硅基电极阵列[17]。该阵列由 4 个独立的子阵列堆叠而成,每个子阵列包括前置芯片、柔性连接线和类似于犹他阵列的 4 柄电极,每柄沿长度方向排布 64 个测量位点(图 2.4)。通过子阵列的堆叠,实现了在 0.6 mm3 区域进行 1024 通道的电记录。
(a)电极和前置芯片组成的子阵列(b)子阵列叠合起来形成 1024 通道记录系统
(c)子阵列叠合的示意图(d)电极柄尖端位点的分布区域
电极通道数目的增多导致电极本体和信号处理单元的尺寸增大,限制了记录系统的应用范围。例如前述工作的前置芯片每片宽度约 4 cm,重约 4.5 g,4 片叠合起来的重量达到 18 g,厚度达到 1 cm,因此不能搭载在自由移动的大鼠脑部,只能进行固定状态下的电生理记录。2017 年,James J. Jun 等人通过将探针与前置芯片集成在一个硅片当中,并采用双波段记录和多路复用技术,极大缩减了电极尺寸和重量、简化了接口连接,推出了含 960 个记录位点,可同时实现 384 通道记录的神经像素电极(Neuropixel)[18]。神经像素的位点分布在一根 1 cm 长的硅微针上,且前置芯片部分尺寸仅 5×9 mm,重量仅 3.0 g(图 2.5)。将两根神经像素电极分别植入小鼠不同脑区,共分离出 741 个神经元信号。2021 年,同研究团队将硅柄的数目从 1 根增加到 4 根,位点数提高至 10240 个,通道数提升至 768 个,植入体重量减轻至 1.1 g,配合先进的信号处理算法 Kilosort,推出了神经像素 2.0 版本[19],使得神经像素系列成为当前小动物在体电生理记录系统的标杆。
(a)神经像素电极柄的结构(b)神经像素记录系统的组成(c)电极柄尖端SEM照片
2.1.3 烯碳微丝电极
近 10 年来,随着新型碳材料的发展,烯碳微丝电极作为新起之秀开始在电生理记录领域崭露头角。烯碳微丝电极由石墨烯或碳纳米管纤维纺丝而成,兼有大的比表面积、高电导率和良好力学性能(具有一定韧性,不易折断)[20],这意味着烯碳微丝电极更加适合于电刺激用途[21]。碳纤维虽属杨氏模量较高的材料(与硅类似,在 100 GPa量级),但在纤维直径小于 20 μm 时,其弯曲刚度可以降至与脑组织相近的 nN·m 量级[22],因此在生物相容性方面更优。限于篇幅原因,烯碳微丝电极的具体研究成果不再赘述。
2.2 柔性微电极的发展历史
柔性电子学(Flexible Electronics) 是将电子元器件负载到柔性基底上组成集成电路的技术。柔性器件目前主要以无源布线结构用于电路间互连,近年来发展出了基于柔性器件的可折叠显示屏、太阳能电池板和可穿戴电子设备[23,24]。
柔性微电极的结构可简化为三明治结构,两层绝缘层包夹一层金属导电层。其中绝缘层多采用高分子材料,如聚酰亚胺(Polyimide,PI)、聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)、聚对二甲苯(Parylene-C)、SU-8 树脂等,金属导电层多采用沉积的 Cr/Au 微线,记录位点通过刻蚀部分绝缘层暴露出来。
近年发展出的柔性微电极主要分为薄膜电极、柔性微丝电极和网状电子器件,其中薄膜电极主要用于进行皮层电记录(μECoG),柔性微丝电极的结构类似于沿电极柄方向排布位点的密歇根型电极阵列,网状电极中包含金属微导线和记录位点的聚合物微丝连接成网格状结构。电极的柔性由薄膜电极到网状电极依次递增,且后两者可通过器件辅助植入皮层内部较浅的区域。以下简要介绍这几类电极的代表性工作。
2.2.1 薄膜电极
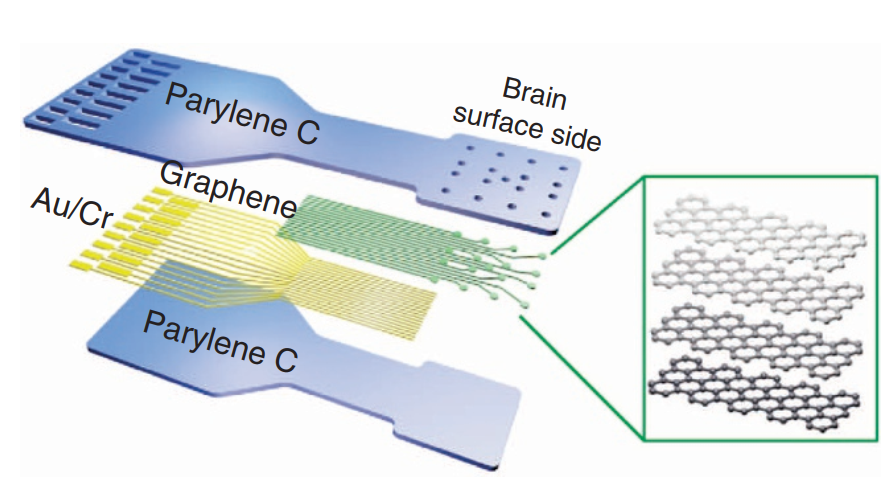
薄膜电极不仅具有良好柔性,若膜厚度薄且透明度高,则可以在电生理记录的同时实现光遗传刺激和成像,构造多模态神经界面。2014 年,Park 等人制备出基于 Parylene-C 和石墨烯的 16 通道透明薄膜电极阵列 CLEARs[25]。其采用 Parylene-C 作为绝缘包覆层,内部导电层和暴露位点在记录位点部分采用透明的石墨烯材料,在与记录系统连接的 IOPad 部分采用 Cr/Au(图 2.6)。将 CLEARs 植入表达光敏感通道蛋白(channelrhodopsin-2)的小鼠皮层表面,同时实现了电生理记录和光遗传刺激。
2020 年,Chiang 等人开发出了一款适用于灵长类动物的大尺寸千通道级 ECoG 薄膜电极神经矩阵(Neural Matrix)[26]。该神经矩阵采用 PI 作为绝缘包覆层,在 9×9.24 mm 的范围内按照 36 行、28 列均匀排布位点(图 2.7)。由于该 ECoG 电极面向 LFP 信号记录,因此采样率可降至 1 kHz。在通道传输带宽减少 1 个数量级的条件下,采用多路复用技术减少引线数量成为可能。该工作将时分复用电路集成到了薄膜中,将引线数量减少到了原来的 10%(从 1008 条减少到 92 条),实现了接口优化。

2021 年,Tchoe 等人推出了一款适用于临床实验的大尺寸千通道级 ECoG 薄膜电极 PtNRGrids[27]。该电极采用 Parylene-C 作为绝缘层,电极尺寸可达为 32×32mm(图 2.8a),位点处修饰铂纳米棒(PtNR)以降低阻抗(图 2.8b)。该工作有两个创新点:一是在薄膜上添加通透的孔道(图 2.8b),以便液体从孔道渗出,使薄膜与皮层表面更紧密地贴合;二是按照 CPU 插槽的制式设计了电极与记录系统的转接板(图 2.8c),为该器件的大规模生产铺平了道路。
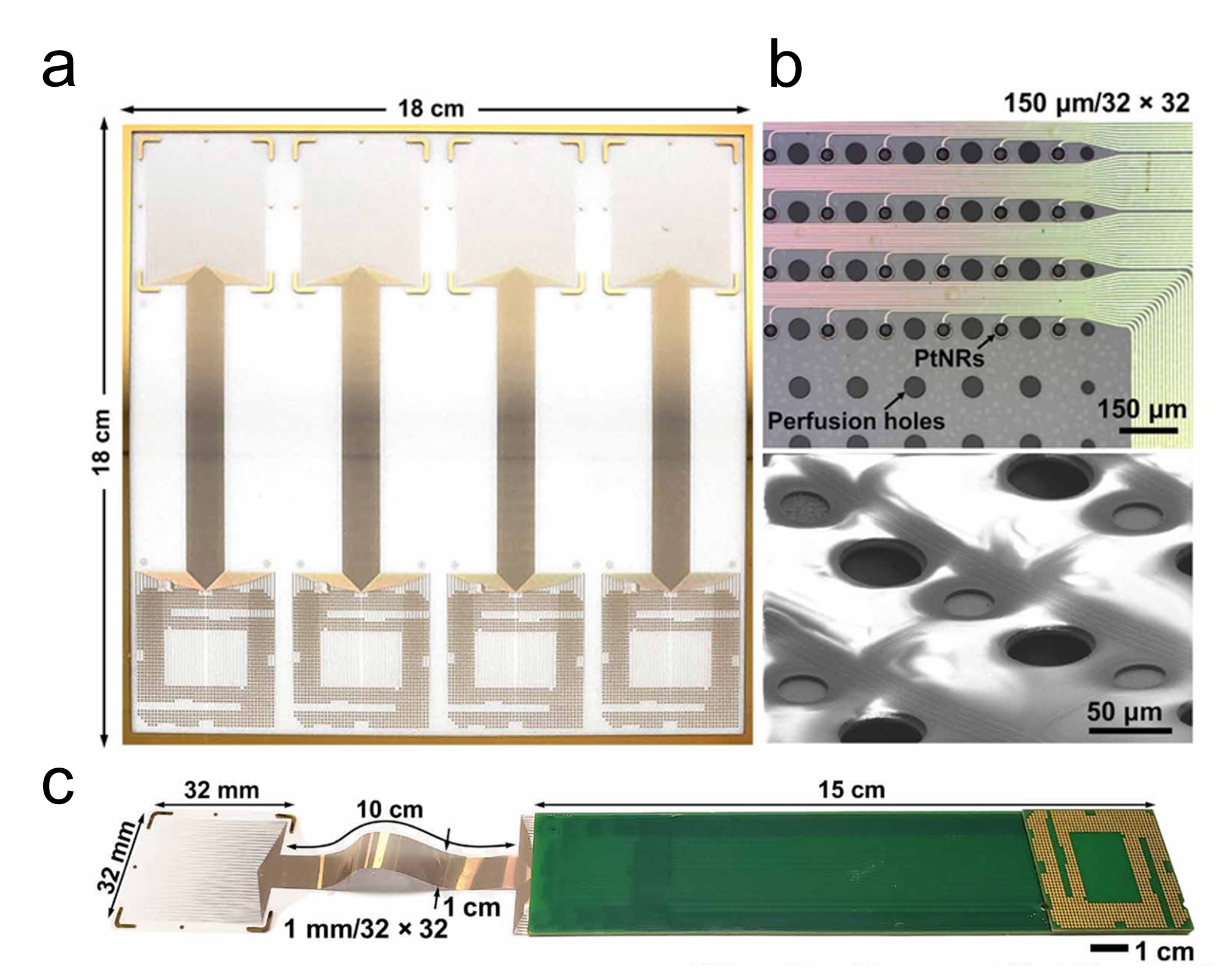
(a)在18×18 cm玻璃板上制备的4对电极(上)和焊盘(下)
(b)铂纳米棒以及孔道照片(c)电极与记录系统转接板的连接
2.2.2 柔性微丝电极
微丝电极相比于薄膜电极,可以植入到皮层内部。虽然柔性微丝对植入组织的损伤较小,但仍需要检测和表征电极植入对组织的影响。较早进行该工作的是Luan 研究团队。2017 年,该团队制备出一种基于 SU-8 的 96 通道柔性微丝电极 NET probe[28],微丝厚度 1.5 μm,宽度 10 μm,长度 1 mm(图 2.9)。将电极植入皮层内部后,采用双光子成像对电极周围组织进行检测。实验结果表明,在植入后长达 4 个月的时间里,脑组织特征未发生明显变化,神经元仍可被持续追踪,体现了柔性微丝电极的良好生物相容性。
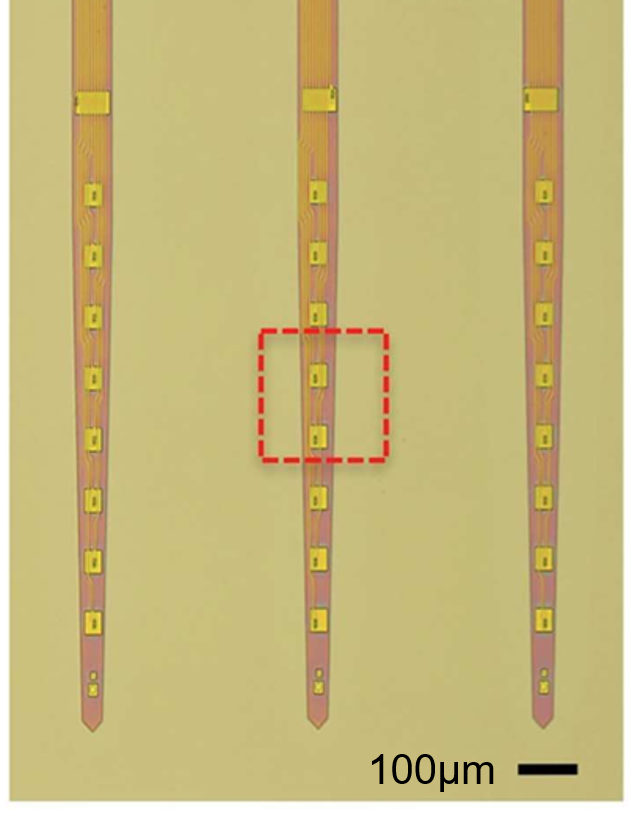
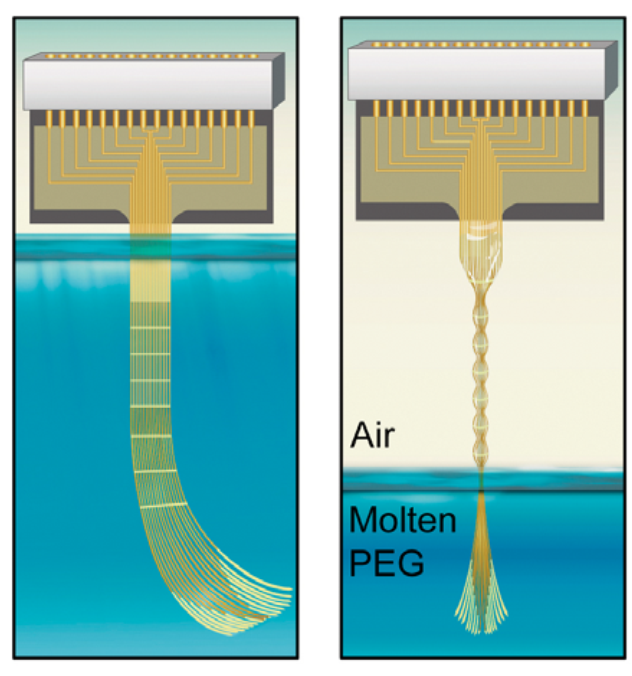
柔性电极不同于刚性电极,不能通过自身硬度穿透硬脑膜,因此在植入时往往需要暂时增加器件的硬度,如将柔性细丝绑定于刚性微针上,植入后再将微针移出,或在微丝上涂覆水溶性材料(如蔗糖、聚乙二醇)形成刚性包覆等。2019 年,Guan 等人巧妙地将利用细丝在液体表面张力作用下的自组装特性,简化了植入流程,推出了神经流苏电极(Neurotassels)[29]。神经流苏的电极部分由焊盘、微丝网格和微丝束三部分组成。其中,微丝束含有 16 到 1024 个截面尺寸仅 3×1.5 μm的聚酰亚胺细丝。植入时,首先将神经流苏浸没到聚乙二醇熔体中,再缓慢拉出液面,在表面张力作用下,神经流苏自组装形成刚性复合细丝(图 2.10)。植入到大脑之后,随聚乙二醇的吸收,微丝束逐渐展开并贴合到神经组织。神经流苏在长达 6 周的小鼠皮层电记录中表现出良好的稳定性和生物相容性。
2019 年,神经链(Neuralink) 公司开发了一套基于柔性微丝电极的千通道级记录系统[30],该系统使用手术机器人,借助刚性微针,自动地将 96 根聚酰亚胺微丝电极植入到小鼠皮层中(图 2.11),每根微丝含 32 个记录位点,因此总的通道数达到了 3072.该系统的前置芯片植入脑中,尺寸仅为 23×18.5×2 mm3。Neuralink 全面集成了柔性多通道电极、植入系统和记录系统,为大规模电生理记录提供了先进完整的解决方案。

(a)微丝电极的结构,其中尖端的环在植入时以刚性微针穿入以辅助植入
(b)机器人植入微丝电极的过程
2.2.3 网状电极
为了使柔性电极的结构和性质更加接近脑组织,实现神经电极与脑组织的高度融合,2015 年,Lieber 团队提出了一种称为网状电子器件(mesh electronics) 的柔性电极设计[31]。该柔性电极为类似于渔网的条带状网格电极,采用 SU-8 作为包覆材料,共有 32 个记录位点。网状电极完全展开后覆盖面积可以达到数十平方厘米,但其厚度不到 1 μm,弯曲刚度更低至 0.09 nN·m,几乎与脑组织一致。网状电极能够被吸入注射器中进而注射到脑组织内部,因此又称为可注射柔性电极(syringe injectable electronics)(图 2.12)。电极植入后,虽在短期(2 周)内在植入区域周围出现胶质细胞增生和神经元的死亡,但随后组织状态逐渐恢复到植入前的水平。该研究团队利用网状电极实现了对小鼠皮层长达 8 个月的稳定电记录[32],表现了网状电极与脑组织的完全亲和性质。
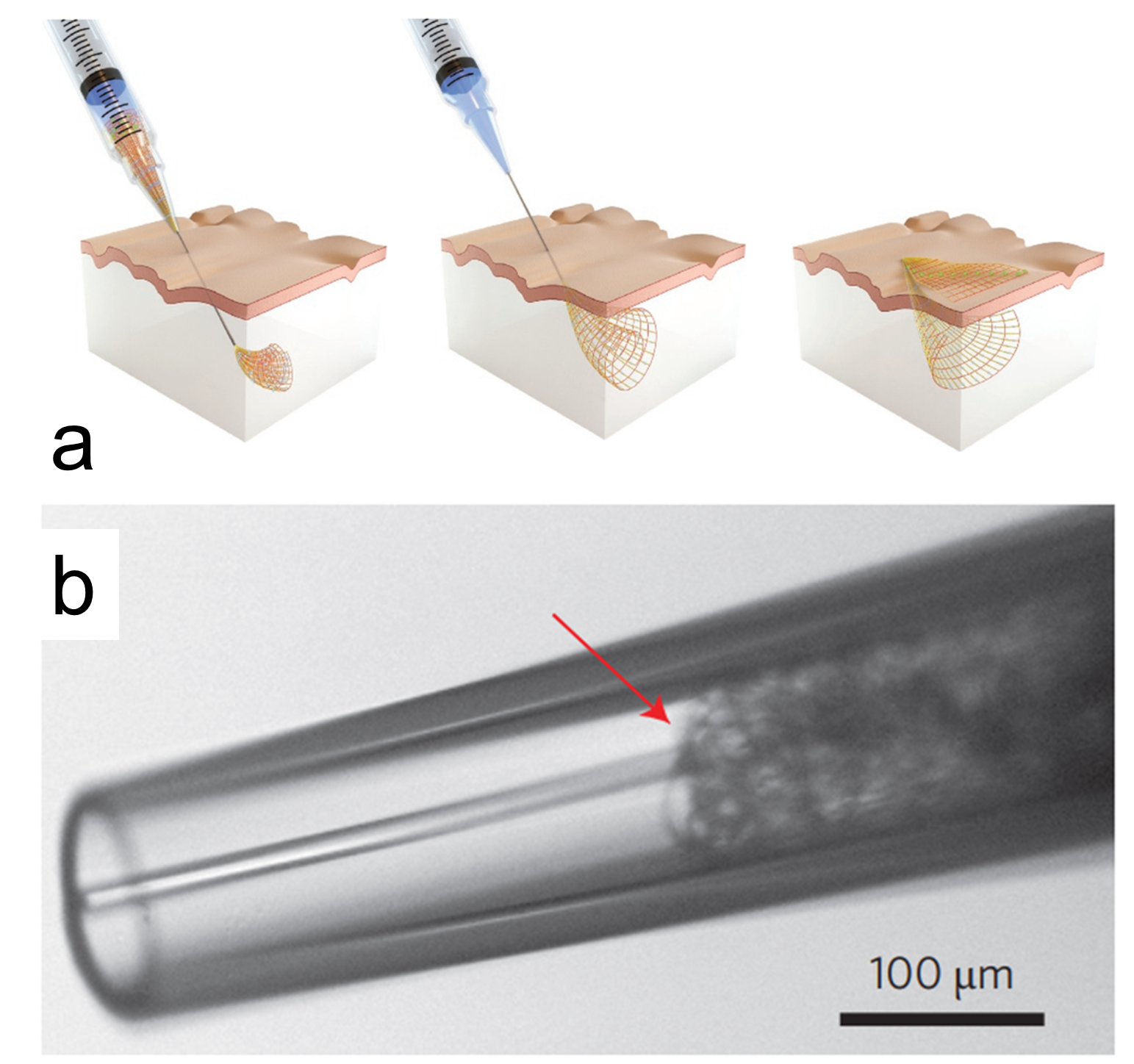
(a)网状电极注射植入过程(b)网状电极在针管中的状态
3 参考文献
[1] Scangos K W, Khambhati A N, Daly P M, et al. Closed-loop neuromodulation in an individual with treatment-resistant depression[J]. Nature Medicine, 2021, 27: 1696–1700.
[2] Jakobs M, Fomenko A, Lozano A M, et al. Cellular, molecular, and clinical mechanisms of action of deep brain stimulation—a systematic review on established indications and outlook on future developments[J]. EMBO Molecular Medicine, 2019, 11(4): e9575.
[3] Moses D A, Metzger S L, Liu J R, et al. Neuroprosthesis for Decoding Speech in a Paralyzed Person with Anarthria[J]. N Engl J Med, 2021, 385(3): 217–227.
[4] Buzsáki G, Anastassiou C A, Koch C. The origin of extracellular fields and currents — EEG, ECoG, LFP and spikes[J]. Nature Reviews Neuroscience, 2012, 13(6): 407–420.
[5] Hong G, Lieber C M. Novel electrode technologies for neural recordings[J]. Nature Reviews Neuroscience, 2019, 20(6): 330–345.
[6] Hodgkin A L, Huxley A F. Action Potentials Recorded from Inside a Nerve Fibre[J]. Nature, 1939, 144(3651): 710–711.
[7] Hubel D H. Tungsten Microelectrode for Recording from Single Units[J]. Science, 1957, 125(3247): 549–50.
[8] Wurtz R H. Recounting the impact of Hubel and Wiesel: Recounting the impact of Hubel and Wiesel[J]. The Journal of Physiology, 2009, 587(12): 2817–2823.
[9] Gray C M, Maldonado P E, Wilson M, et al. Tetrodes markedly improve the reliability and yield of multiple single-unit isolation from multi-unit recordings in cat striate cortex[J]. Journal of Neuroscience Methods, 1995, 63(1–2): 43–54.
[10] McNaughton B L, O’Keefe J, Barnes C A. The stereotrode: A new technique for simultaneous isolation of several single units in the central nervous system from multiple unit records[J]. Journal of Neuroscience Methods, 1983, 8(4): 391–397.
[11] Wilson M A, McNaughton B L. Dynamics of the Hippocampal Ensemble Code for Space[J]. Science, 1993, 261(5124): 1055–1058.
[12] Obaid A, Hanna M-E, Wu Y-W, et al. Massively parallel microwire arrays integrated with CMOS chips for neural recording[J]. Science Advances, 2020, 6(12): eaay2789.
[13] Sahasrabuddhe K, Khan A A, Singh A P, et al. The Argo: A high channel count recording system for neural recording in vivo[J]. Journal of Neural Engineering, 2020, 18: 015002.
[14] Wise K D, Angell J B, Starr A. An Integrated-Circuit Approach to Extracellular Microelectrodes[J]. IEEE Transactions on Biomedical Engineering, 1970, BME-17(3): 238–247.
[15] Lee W H. Needle-type environmental microelectrode sensors for biofilm study in aqueous systems[A]. Proceedings of the 11th IEEE International Conference on Networking, Sensing and Control[C]. 2014: 185–190.
[16] Maynard E M, Nordhausen C T, Normann R A. The Utah Intracortical Electrode Array: A recording structure for potential brain-computer interfaces[J]. Electroencephalography and Clinical Neurophysiology, 1997, 102(3): 228–239.
[17] Rios G, Lubenov E V, Chi D, et al. Nanofabricated Neural Probes for Dense 3-D Recordings of Brain Activity[J]. Nano Letters, 2016, 16(11): 6857–6862.
[18] Jun J J, Steinmetz N A, Siegle J H, et al. Fully integrated silicon probes for high-density recording of neural activity[J]. Nature, 2017, 551(7679): 232–236.
[19] Steinmetz N A, Aydin C, Lebedeva A, et al. Neuropixels 2.0: A miniaturized high-density probe for stable, long-term brain recordings[J]. Science, 2021, 372(6539): eabf4588.
[20] Liu Y, Duan X. Carbon-based Nanomaterials for Neural Electrode Technology[J]. Acta Physico Chimica Sinica, 2020, 0(0): 2007066–0.
[21] Yu X, Su J Y, Guo J Y, et al. Spatiotemporal characteristics of neural activity in tibial nerves with carbon nanotube yarn electrodes[J]. Journal of Neuroscience Methods, 2019, 328: 108450.
[22] Vitale F, Vercosa D G, Rodriguez A V, et al. Fluidic Microactuation of Flexible Electrodes for Neural Recording[J]. Nano Letters, 2018, 18(1): 326–335.
[23] Cai S, Han Z, Wang F, et al. Review on flexible photonics/electronics integrated devices and fabrication strategy[J]. Science China Information Sciences, 2018, 61(6): 060410.
[24] Liu F, Han J-L, Qi J, et al. Research and Application Progress of Intelligent Wearable Devices[J]. Chinese Journal of Analytical Chemistry, 2021, 49(2): 159–171.
[25] Park D W, Schendel A A, Mikael S, et al. Graphene-based carbon-layered electrode array technology for neural imaging and optogenetic applications[J]. Nat Commun, 2014, 5: 5258.
[26] Chiang C-H, Won S M, Orsborn A L, et al. Development of a neural interface for high-definition, long-term recording in rodents and nonhuman primates[J]. Science Translational Medicine, 2020, 12(538): eaay4682.
[27] Tchoe Y, Bourhis A M, Cleary D R, et al. Human brain mapping with multithousand-channel PtNRGrids resolves spatiotemporal dynamics[J]. Science Translational Medicine, 2022, 14(628): eabj1441.
[28] Luan L, Wei X, Zhao Z, et al. Ultraflexible nanoelectronic probes form reliable, glial scar–free neural integration[J]. Science Advances, 2017, 3(2): e1601966.
[29] Guan S, Wang J, Gu X, et al. Elastocapillary self-assembled neurotassels for stable neural activity recordings[J]. Science Advances, 2019, 5(3): eaav2842.
[30] Musk E, Neuralink. An Integrated Brain-Machine Interface Platform With Thousands of Channels[J]. J Med Internet Res, 2019, 21(10): e16194.
[31] Liu J, Fu T-M, Cheng Z, et al. Syringe-injectable electronics[J]. Nature Nanotechnology, 2015, 10(7): 629–636.
[32] Fu T-M, Hong G, Zhou T, et al. Stable long-term chronic brain mapping at the single-neuron level[J]. Nature Methods, 2016, 13(10): 875–882.